Informācija par prasībām un ekspluatācijas sistēmu elektroierīcēm un medicīniskajām ierīcēm skaistumkopšanā
Veselības inspekcija atgādina, ka 2023. gada 23. augustā stājās spēkā Ministru kabineta 2023. gada 15. augusta noteikumi Nr.461 “Medicīnisko ierīču noteikumi” (turpmāk – noteikumi).
Jaunie noteikumi par medicīniskajām ierīcēm ir pieņemti, lai īstenotu no Eiropas Parlamenta un Padomes Regulas (ES) 2017/745 par medicīniskām ierīcēm (turpmāk – Regula 2017/745) normām izrietošās saistības.
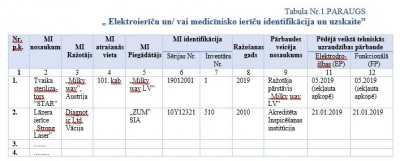
Ekspluatācijas sistēmas mērķis ir panākt izpratni par elektroierīces un medicīniskās ierīces “dzīves ciklu” skaistumkopšanas salonā, ārstniecības iestādē un citur (turpmāk – iestāde), kur ir nodarbinātās personas, kuras lieto Regulas Nr. 2017/745 16. pielikumā minētos izstrādājumus1 sniedzot skaistumkopšanas pakalpojumus no iegādes brīža līdz utilizācijai, ievērojot noteiktos norādījumus normatīvajos aktos.