Medicīnas ierīcēm un in vitro diagnostikas medicīnas ierīcēm prasības nosaka Ministru kabineta 2017. gada 28. novembra noteikumi Nr.689 „Medicīnisko ierīču reģistrācijas, atbilstības novērtēšanas, izplatīšanas, ekspluatācijas un tehniskās uzraudzības kārtība” (turpmāk – Noteikumi Nr.689).
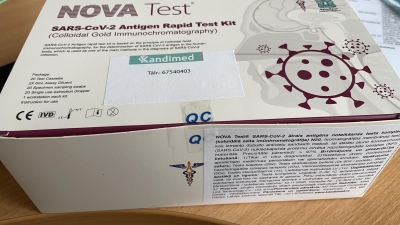
Veselības inspekcijas (turpmāk - Inspekcija) kontroles rezultātā uzņēmuma SIA „MS Hansa” tīmekļvietnē https://kandimed.lv/ apturēja preces SARS-CoV-2 eksprestestu „NOVA Test SARS-CoV-2 Antigen Rapid Test Kit (Colloidal Gold Immunochromatography)”LOT 20201105, ražotājs – Atlas Link Technology, Ķīna, (turpmāk - Tests) izplatīšanu.
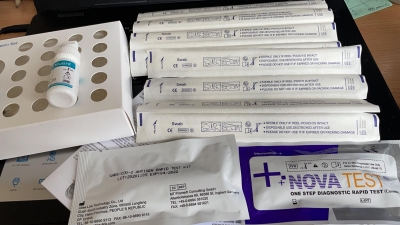
Inspekcija informē, ka izvērtējot Testa iepakojuma un komponenšu atbilstību Noteikumu Nr.689 prasībām, tika konstatēts, ka Testā iekļauto paraugu savākšanas kociņu „Swab”(LOT 20060241-01) iepakojums ir marķēts kā sterils, toties blakus CE atbilstības marķējumam nav norādīts paziņotās iestādes, kas veikusi atbilstības novērtēšanas procedūru, identifikācijas numurs, kā arī uz paraugu savākšanas tamponu iepakojuma nav identificējams ražotājs un/vai ražotāja pilnvarotais pārstāvis Eiropas Savienībā. Līdz ar to paraugu savākšanas kociņi nav atbilstoši Noteikumu Nr. 689 13. un 58. punkta prasībām.
Inspekcija iesaka patērētājiem, kuri ir iegādājušies Testu, sazināties ar preces izplatītāju SIA „MS Hansa”, e-pasts: info@kandimed.lv vai izmantojot tālruni +371 2 5713491.