Medicīniskās sejas maskas, kas paredzētas lietošanai operāciju zālēs un veselības aprūpes vietās ar līdzīgām prasībām, ir veidotas tā, lai aizsargātu visu darba vidi. Pēc standarta EN 14683:2019 „Medicīniskās sejas maskas. Prasības un testēšanas metodes.” (turpmāk – Standarts 14683), medicīniskās sejas maskas tiek iedalītas trīs tipos – I, II un IIR, kur katram no tipiem ir atšķirīgas prasības bakteriālai filtrācijas efektivitātei, diferenciālajam spiedienam, mikrobiālai tīrībai un izturībai pret šļakatām (tikai IIR tipam).
Veselības inspekcija vērš uzmanību, ka prasības medicīniskajām ierīcēm nosaka Ministru kabineta 2017.gada 28.novembra noteikumi Nr.689 „Medicīnisko ierīču reģistrācijas, atbilstības novērtēšanas, izplatīšanas, ekspluatācijas un tehniskās uzraudzības kārtība” (turpmāk – Noteikumi Nr.689).
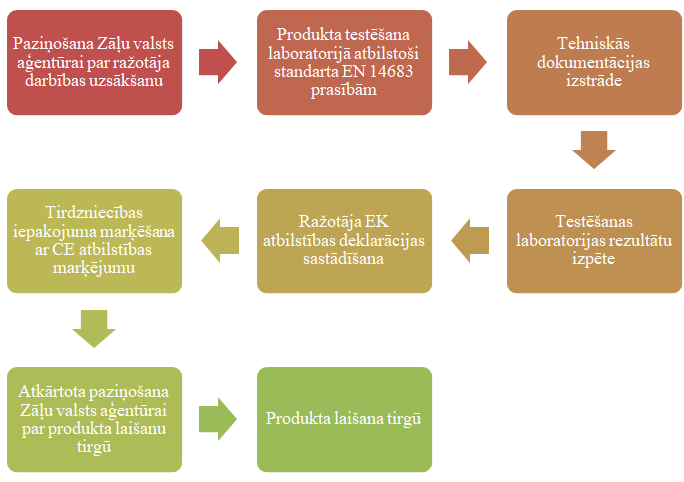
Medicīnisko masku ražotāji, kuru komercdarbības vieta reģistrēta Latvijas Republikā, uzsākot darbību, iesniedz Zāļu valsts aģentūrā iesniegumu ar sekojošu informāciju: nosaukumu (komersanta firmu); reģistrācijas numuru; juridisko adresi; ražotnes vai filiāles adresi (ja tāda ir); tālruņa numuru un elektroniskā pasta adresi; ražoto vai komplektēto medicīnisko ierīču nosaukumu un paredzēto nolūku. Pēc paziņošanas procedūras veikšanas Zāļu valsts aģentūrā, ražotājs ir atbildīgs, ka medicīnas ierīce atbilst noteiktajām prasībām t.i. Standarta 14683, Padomes Direktīvas 93/42/EK par medicīnas ierīcēm (turpmāk – Direktīva 93/42/EK) vai Eiropas Parlamenta un Padomes Regulas 2017/745, kas attiecas uz medicīniskām ierīcēm (turpmāk – Regula 2017/745) būtiskajām prasībām.
Direktīvas 93/42/EK un Regulas 2017/745 prasības nosaka, ka medicīniskās ierīces ražotājam ir jābūt izstrādātai tehniskajai dokumentācijai (tehniskajam failam), kur ražotājs apraksta ražošanas procesu. Tehniskajai dokumentācijai jābūt tādai, kas ļauj novērtēt ražojuma atbilstību Noteikumu Nr.689 prasībām. Tehniskajā dokumentācijā ietver:
- vispārīgu ražojuma aprakstu, iekļaujot visus plānotos ražojuma variantus, kā arī tā paredzēto izmantošanas veidu;
- uzbūves rasējumus, paredzētās ražošanas metodes, kā arī sastāvdaļu, detaļu bloku, elektrības un citas shēmas;
- aprakstus un paskaidrojumus, kas nepieciešami, lai izprastu šī pielikuma 3.2. apakšpunktā minētos rasējumus, shēmas un medicīniskās ierīces darbību;
- riska analīzes rezultātus un pilnībā vai daļēji piemēroto standartu sarakstu, kā arī to risinājumu aprakstu, kas izraudzīti, lai izpildītu būtiskās prasības, ja attiecīgie standarti nav piemēroti pilnībā;
- attiecībā uz ražojumiem, ko laiž apgrozībā sterilā veidā – izmantoto sterilizācijas metožu aprakstu un validācijas ziņojumu;
- uzbūves aprēķinu, veikto pārbaužu un citus rezultātus;
- ja, lai medicīniskā ierīce funkcionētu atbilstoši paredzētajam mērķim, tā jāpieslēdz citai ierīcei vai citām ierīcēm – apliecinājumu, ka tā atbilst būtiskajām prasībām arī pieslēgumā citai medicīniskajai ierīcei vai citām ierīcēm, kurām ir ražotāja norādītie parametri;
- etiķetes un lietošanas instrukcijas paraugus;
- izstrādes un uzbūves risinājumus atbilstoši šo noteikumu 36. punkta prasībām;
- pirmsklīnisko izvērtējumu;
- klīnisko izvērtējumu.
Lai pārliecinātos par saražotā produkta atbilstību medicīnisko masku standarta prasībām, ražotājam ir jāveic pārbaudes – medicīnisko masku testēšana laboratorijā atbilstoši Standarta 14683 prasībām. Kad ražotājs no laboratorijas ir ieguvis apliecinājumus par saražotās medicīniskās maskas atbilstību prasībām, pamatojoties uz normatīvā akta prasībām, medicīnisko masku ražotājs sastāda EK atbilstības deklarāciju, ar ko apliecina medicīniskās maskas atbilstību prasībām. Kad ražotājs ir ieguvis apstiprinājumu par saražotās preces atbilstību, tas veic atkārtotu paziņošanu Zāļu valsts aģentūrā, norādot informāciju par saražotajām precēm un pievienojot apliecinošu dokumentāciju par atbilstības novērtēšanas procedūrām. Ja ražotājs var apliecināt saražotās medicīniskās maskas atbilstību prasībām, ražotājs ir tiesīgs marķēt saražotā produkta tirdzniecības iepakojumu ar CE atbilstības marķējumu. Ja ražotājs ir veicis visas iepriekš norādītās darbības – izveidojis tehnisko dokumentāciju, veicis pārbaudes laboratorijā, sastādījis EK atbilstības deklarāciju un veicis tirdzniecības iepakojuma marķēšanu ar CE atbilstības marķējumu, tad medicīniskās sejas maskas var laist tirgū.