Ņemot vērā pieaugošo jautājumu un pieprasījumu skaitu par SARS-CoV-2 testiem un to atbilstību, Veselības inspekcija informē SARS-CoV-2 ātro antigēnu testu (turpmāk – Tests) izplatītājus un patērētājus par Eiropas Komisijas izstrādātiem ieteikumiem 2020/1743 (2020. gada 18. novembris) par ātro antigēna testu izmantošanu, lai diagnosticētu SARS-CoV-2 infekciju.
Pamatojoties uz ieteikumos minēto, Testu laišanu tirgū reglamentē Eiropas Parlamenta un Padomes Direktīva 98/79/EK (1998. gada 27. oktobris) par medicīnas ierīcēm, ko lieto in vitro diagnostikā (turpmāk – Direktīva 98/79). Vēršam uzmanību, ka Direktīvas 98/79 prasības ir pārņemtas ar Ministru kabineta 2017. gada 28. novembra noteikumiem Nr. 689 „Medicīnisko ierīču reģistrācijas, atbilstības novērtēšanas, izplatīšanas, ekspluatācijas un tehniskās uzraudzības kārtība” (turpmāk – Noteikumi Nr.689). Noteikumi Nr.689 nosaka, ka ražotājs pirms medicīnas ierīces laišanas brīvā apgrozībā izdod EK atbilstības deklarāciju un norāda medicīnas ierīces atbilstību attiecināmajām prasībām un tās klasi. Atkarībā no ražotāja paredzētā testa lietošanas nolūka, tie ir klasificējami kā pašpārbaudes (selft-testing) vai citas (others) in vitro diagnostikas medicīnas ierīces.
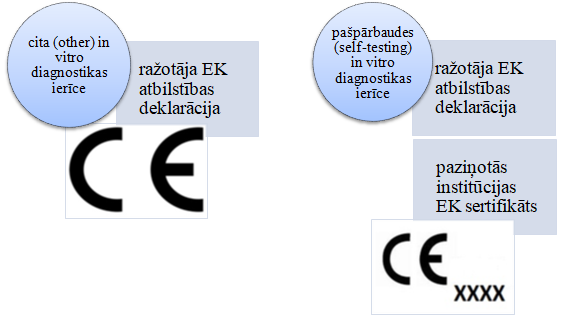
Lai pārliecinātos par in vitro diagnostikas medicīnas ierīces atbilstību prasībām, ir nepieciešami sekojoši dokumenti:
Norādām, ka in vitro diagnostikas medicīnas ierīcēm, kas klasificētas kā citas (other), ir jābūt marķētām ar CE atbilstības marķējumu, savukārt pašpārbaudes (self-testing) in vitro diagnostikas medicīnas ierīcēm ir jābūt marķētām ar CE atbilstības marķējumu, kur pie CE marķējuma ir norādīts paziņotās institūcijas identifikācijas kods.